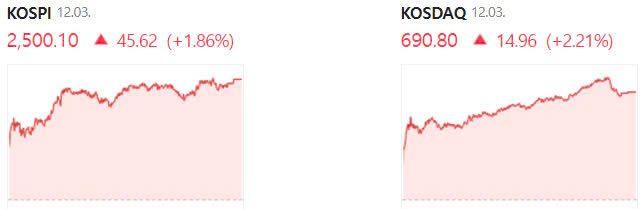
Chỉ số KOSPI tăng 1,86% và KOSDAQ tăng 2,21% khi kết thúc phiên giao dịch
Cellid – Hoàn tất đăng ký bằng sáng chế công nghệ nền tảng kháng nguyên vắc-xin COVID-19 tại Hàn Quốc
Phóng viên Lee Woo Sang
Thị trường chứng khoán Hàn Quốc hôm nay: Cổ phiếu Cellid tăng trần nhờ thông tin hoàn tất đăng ký bằng sáng chế cho công nghệ nền tảng kháng nguyên vắc-xin COVID-19 tại Hàn Quốc.
Vào ngày 3/12, Cellid cho biết họ đã hoàn tất quá trình đăng ký bằng sáng chế được áp dụng cho công nghệ nền tảng kháng nguyên vắc-xin, sử dụng trong vắc-xin COVID-19 mang tên AdCLD-CoV19-1 OMI.
Bằng sáng chế này liên quan đến công nghệ tối ưu hóa cấu trúc protein gai SARS-CoV-2, là kháng nguyên của vắc-xin AdCLD-CoV19-1 OMI mà công ty đang phát triển.
Ngoài Hàn Quốc ra, Cellid cũng đã nộp đơn xin cấp bằng sáng chế tại các quốc gia chủ chốt khác như Mỹ, Châu Âu, Nhật Bản, Trung Quốc, Ấn Độ, Brazil, Singapore, Thái Lan, Việt Nam, Indonesia, v.v.. và hiện đang chờ kết quả thẩm định.
Trước đó, vào tháng 4 năm nay, công ty đã đăng ký thành công bằng sáng chế này tại Nga.
Sau khi tiêm vắc-xin, protein gai được tạo ra trong cơ thể có thể bị cắt bởi enzyme tại vị trí cắt furin, làm giảm thời gian hiệu quả của protein trong cơ thể.
Để giải quyết vấn đề này, Cellid đã áp dụng công nghệ làm vô hiệu hóa vị trí cắt furin, giúp tăng độ ổn định của protein gai và cải thiện tính sinh miễn dịch của vắc-xin.
Đại diện Cellid chia sẻ: “Việc đăng ký bằng sáng chế này không chỉ giúp giảm lo ngại về các tranh chấp bằng sáng chế trong tương lai mà còn giảm sự phụ thuộc vào công nghệ nước ngoài.
Đây cũng là một bước tiến lớn trong việc thiết lập vị thế độc lập để đối phó với các biến thể COVID-19 có thể xuất hiện trong tương lai”.
Vắc-xin AdCLD-CoV19-1 OMI của Cellid là một sản phẩm vắc-xin nội địa thuần túy, được kết hợp giữa công nghệ nền tảng kháng nguyên do công ty tự phát triển và công nghệ nền tảng vector adenovirus độc quyền.
Bằng sáng chế cho vector này cũng đã được cấp tại Mỹ, Nga, Trung Quốc và Nhật Bản trong năm nay. Với việc bổ sung bằng sáng chế nền tảng kháng nguyên, công ty tuyên bố đã hoàn thiện quyền sở hữu trí tuệ cho công nghệ vắc-xin của mình.
Ông Kang Chang-Yul, Giám đốc điều hành Cellid, nhấn mạnh: “Bằng sáng chế nền tảng kháng nguyên lần này, cùng với bằng sáng chế nền tảng vector, là yếu tố thiết yếu trong phát triển và thương mại hóa vắc-xin.
Điều này mang ý nghĩa lớn vì đã giúp loại bỏ triệt để nguy cơ tranh chấp bằng sáng chế, chi phí phát sinh khổng lồ và sự phụ thuộc vào công nghệ nước ngoài – điều mà phần lớn các công ty hiện nay đang phải đối mặt”.
Nibec – Xác nhận hiệu quả giảm hơn 3 lần Chỉ số Hoạt động Bệnh (DAI) nhờ nền tảng phân phối thuốc độc quyền, mở rộng ứng dụng sang thuốc uống và tiềm năng điều trị béo phì
Phóng viên Kim Kyung-ah

Được cung cấp bởi Naivek.
Vào ngày 3, Nibec thông báo rằng trong nghiên cứu về dạng thuốc uống dựa trên nền tảng phân phối thuốc độc quyền NIPEP-TPP, công ty đã xác nhận hiệu quả giảm hơn 3 lần Chỉ số Hoạt động Bệnh (Disease Activity Index – DAI) so với trước.
Thông qua kết quả này, công nghệ NIPEP-TPP của Nibec đã chứng minh khả năng mở rộng từ dạng thuốc tiêm dưới da (SC) sang dạng thuốc uống.
Nibec có kế hoạch bắt đầu với thuốc điều trị bệnh viêm đường ruột (Inflammatory Bowel Disease – IBD) ở dạng thuốc uống và mở rộng sang phát triển thuốc điều trị béo phì.
Đồng thời, công ty cũng đang hợp tác nghiên cứu với các tập đoàn dược phẩm toàn cầu nhằm đẩy nhanh việc áp dụng nền tảng NIPEP-TPP vào nhiều loại thuốc mới.
Trong thí nghiệm trên mô hình chuột mắc bệnh viêm đường ruột cấp tính và mãn tính do hóa chất gây ra, việc sử dụng dạng thuốc uống NP-201 đã cho thấy cấu trúc ruột của chuột hồi phục hoàn toàn như trạng thái bình thường.
Ngoài ra, khi sử dụng dạng thuốc uống, chỉ số DAI đã giảm hơn 3 lần so với mức độ bệnh ban đầu, vượt trội hơn 2 lần so với phương pháp điều trị tiêu chuẩn hiện tại và 1,5 lần so với dạng thuốc tiêm dưới da.
Nibec cho biết sẽ đưa cả dạng thuốc uống và thuốc tiêm vào thử nghiệm lâm sàng giai đoạn 2 đối với thuốc điều trị viêm đường ruột.
Công ty đã nhận được phê duyệt thử nghiệm lâm sàng giai đoạn 1b/2a tại Úc vào tháng trước. Sau khi hoàn tất giai đoạn 1b tại Úc, Nibec dự kiến nộp đơn xin FDA Hoa Kỳ phê duyệt giai đoạn 2, mở rộng phạm vi thử nghiệm sang các quốc gia khác.
Nibec đang mở rộng ứng dụng của NP-201 không chỉ đối với bệnh viêm đường ruột mà còn sang điều trị béo phì, xơ hóa phổi (Pulmonary Fibrosis), và tăng huyết áp động mạch phổi (Pulmonary Hypertension).
Kết quả tích cực từ dạng thuốc uống trong điều trị viêm đường ruột đã mở ra tiềm năng lớn cho việc áp dụng dạng bào chế này vào các loại thuốc khác sử dụng cùng thành phần.
Đại diện Nibec nhấn mạnh: “Các chế phẩm sinh học dạng thuốc uống, bao gồm peptide, mang lại nhiều lợi ích như sự tiện lợi, cải thiện khả năng thích nghi của bệnh nhân và tối ưu chi phí so với dạng tiêm dưới da.
Tuy nhiên, những hạn chế về tỷ lệ hấp thụ qua đường tiêu hóa và khả dụng sinh học (bioavailability) thấp đã khiến việc phát triển bị giới hạn.
Dạng thuốc uống mà Nibec đang phát triển không chỉ cải thiện đáng kể khả dụng sinh học trong mô ruột già so với dạng thuốc tiêm, mà còn cho thấy hiệu quả vượt trội, làm tăng giá trị ứng dụng trên thị trường toàn cầu”.
Nibec kỳ vọng với bước tiến mới này, nền tảng NIPEP-TPP sẽ tạo ra đột phá trong điều trị và thương mại hóa các loại thuốc mới.
HLB – Phương pháp kết hợp Rivoceranib được phê duyệt làm thuốc điều trị ung thư vú tại Trung Quốc
Phóng viên Doo-seon Choi
HLB và đối tác Hengrui Pharma đang mở rộng nhanh chóng các chỉ định của thuốc Rivoceranib.

Được cung cấp bởi HLB
Sau khi đạt thành công trong điều trị ung thư gan, kỳ vọng về việc mở rộng thử nghiệm lâm sàng trên toàn cầu đối với Rivoceranib tiếp tục gia tăng.
Vào ngày 3/12, đại diện HLB cho biết: “Hengrui Pharma, đối tác giữ bản quyền phân phối Rivoceranib tại Trung Quốc, đã liên tiếp nhận được những phê duyệt thuốc mới, từ phương pháp kết hợp Rivoceranib với Camrelizumab cho đến phương pháp kết hợp Rivoceranib và Fluzoparib, điều này làm tăng kỳ vọng về hiệu quả và tính đa dụng của Rivoceranib”.
Mới đây, Cục Quản lý Dược phẩm Quốc gia Trung Quốc (NMPA) đã phê duyệt phương pháp kết hợp Rivoceranib và Fluzoparib (một chất ức chế PARP do Hengrui Pharma phát triển) hoặc Fluzoparib đơn trị liệu làm thuốc điều trị ung thư vú âm tính HER2 có đột biến gien gBRCA.
Trước đó, vào tháng 4, liệu pháp kết hợp Rivoceranib đã được phê duyệt để điều trị ung thư buồng trứng.
Và trong lần này, công nghệ tiếp tục được chấp thuận là thuốc mới cho điều trị ung thư vú.
Theo dữ liệu được công bố tại Hội nghị Ung thư Châu Âu (ESMO) vào tháng 5, kết quả thử nghiệm lâm sàng giai đoạn 3 trên 203 bệnh nhân ung thư vú di căn cho thấy thời gian sống không tiến triển bệnh (mPFS) của phương pháp kết hợp Rivoceranib và Fluzoparib là 11,0 tháng, cao hơn hẳn so với Fluzoparib đơn trị liệu (6,7 tháng) và hóa trị liệu tiêu chuẩn (3,0 tháng).
Phương pháp kết hợp này cũng cho thấy lợi ích vượt trội về thời gian sống toàn bộ (mOS) và tỷ lệ đáp ứng khách quan (ORR), đồng thời giảm khoảng 73% nguy cơ bệnh tiến triển nghiêm trọng ở bệnh nhân.
Với kết quả tích cực từ điều trị ung thư buồng trứng và ung thư vú, HLB và Hengrui Pharma đang tăng cường thảo luận hợp tác để mở rộng nghiên cứu.
Để đưa phương pháp kết hợp Rivoceranib và Fluzoparib ra ngoài Trung Quốc, đặc biệt là tại Mỹ và Châu Âu, cần có sự hợp tác chặt chẽ giữa HLB – đơn vị nắm quyền sáng chế toàn cầu của Rivoceranib – và Hengrui Pharma – nhà phát triển Fluzoparib.
Đại diện HLB chia sẻ: “Chúng tôi đã đạt được những bước tiến quan trọng trong phát triển thuốc điều trị ung thư gan giai đoạn đầu (kết hợp Rivoceranib và Camrelizumab) và đang tiến gần hơn tới một loại thuốc mới mang tính toàn cầu.
Với dữ liệu lâm sàng từ Trung Quốc, chúng tôi hoàn toàn có thể triển khai ngay thử nghiệm lâm sàng giai đoạn 3 toàn cầu tại Mỹ và các quốc gia khác”.
Kumho HT – Thuốc điều trị ung thư miễn dịch DNP-002 đang tiến triển thuận lợi trong giai đoạn thử nghiệm lâm sàng 1, nhắm đến thị trường toàn cầu cho các bệnh ung thư thể rắn
Phóng viên Yoo Hyeon-seok
Vào ngày 3, Kumho HT thông báo rằng thuốc điều trị ung thư miễn dịch DNP-002 do công ty tự phát triển đang tiến triển thuận lợi trong giai đoạn thử nghiệm lâm sàng 1.

DNP-002 được cấp phép bởi Cục Quản lý Thực phẩm và Dược phẩm Hàn Quốc (MFDS) vào tháng 8 năm 2020 để thử nghiệm trên các bệnh ung thư thể rắn như ung thư đại trực tràng, ung thư thực quản và ung thư dạ dày, v.v…
Hiện nay, thử nghiệm lâm sàng đang được tiến hành tại Bệnh viện Asan Seoul và Trung tâm Ung thư Quốc gia Hàn Quốc, với sự tham gia của 36 bệnh nhân mắc các loại ung thư thể rắn.
Giai đoạn này nhằm đánh giá độ an toàn, khả năng hấp thụ và liều lượng tối ưu của DNP-002. Kumho HT đã xác định được ngưỡng điều trị hứa hẹn mang lại hiệu quả chống ung thư trong khi giảm thiểu tác dụng phụ ở bệnh nhân.
Công ty dự kiến công bố kết quả thử nghiệm giữa kỳ tại Hội nghị Ung thư Châu Âu (ESMO) được tổ chức trong tháng này.
DNP-002 được phát triển như một liệu pháp điều trị cho nhiều loại ung thư thể rắn, bao gồm ung thư đại trực tràng.
Thuốc nhắm đích vào protein CEACAM6, một loại protein được biểu hiện quá mức trên các tế bào ung thư và các tế bào ức chế miễn dịch từ bạch cầu trung tính (MDSC).
Bằng cách đồng thời tấn công khối u và MDSC, DNP-002 kích hoạt lại hệ thống miễn dịch của bệnh nhân, từ đó gia tăng hiệu quả điều trị ung thư.
Kumho HT đã chính thức gia nhập lĩnh vực sinh học vào năm 2021 thông qua việc sáp nhập với công ty phát triển thuốc DiNonA. Hiện công ty đang phát triển một danh mục đa dạng gồm:
DNP-005: Thuốc điều trị ung thư thể rắn.
DNP-019: Thuốc điều trị COVID-19.
DNP-007: Thuốc điều hòa miễn dịch, nhắm đến các bệnh như viêm khớp dạng thấp.
KHT-2031: Thuốc điều trị viêm da dị ứng cho thú cưng.
MediaZen được chọn là “Đối tác Xuất sắc NIPA 2024”
Phóng viên Jang Hyo-won
MediaZen thông báo vào ngày 3/12 rằng họ đã được chọn là “Đối tác Xuất sắc NIPA 2024” bởi Viện Xúc tiến Công nghiệp Thông tin và Truyền thông (NIPA) tuyển chọn, nhờ những thành tựu nghiên cứu nổi bật của mình.
Danh hiệu này được trao cho các doanh nghiệp đã tạo ra những câu chuyện thành công đáng chú ý hoặc thể hiện tiềm năng tăng trưởng thông qua các dự án hoặc nhiệm vụ nghiên cứu được NIPA hỗ trợ trong năm.
Năm nay, trong số 2.391 tổ chức và doanh nghiệp, chỉ có 41 đơn vị được lựa chọn qua quy trình đánh giá nghiêm ngặt ở từng lĩnh vực.
Trước đó, vào tháng 7, MediaZen đã được chọn tham gia vào dự án hợp tác liên bộ nhằm mở rộng ứng dụng trí tuệ nhân tạo (AI), do NIPA chịu trách nhiệm triển khai. MediaZen đang phát triển và thử nghiệm một giải pháp tích hợp AI vào nền tảng kiểm tra hợp đồng của Ủy ban Thương mại Công bằng (KFTC).
Công ty tập trung vào việc ứng dụng mô hình ngôn ngữ lớn (LLM) do chính họ phát triển, mang tên Mirage, để xây dựng một giải pháp kiểm tra các điều khoản hợp đồng đa dạng và phức tạp.
Giải pháp này hướng đến việc ngăn chặn xử lý lặp lại trong việc kiểm tra hợp đồng và nâng cao hiệu quả thông qua tự động hóa.
>>> Tham gia đầu tư chứng khoán Hàn Quốc ngay hôm nay, tiếp cận thị trường mới tìm kiếm cơ hội đạt lợi nhuận lớn cùng chuyên gia Bucket-VN :
- Đăng ký tư vấn miễn phí và bắt tín hiệu thị trường chứng khoán Hàn Quốc tại: https://bucketvn.com/dang-ky-tu-van/
- Hotline: 028 3636 6553
- Group Facebook thảo luận: https://www.facebook.com/groups/bucketvn



 English
English